Introduzione
La malattia da reflusso gastro-esofageo (mRGE) è una problematica diffusa, con una prevalenza compresa tra il 10 ed il 20%, ed un’incidenza annua di 5 nuovi casi ogni 1000 abitanti nei paesi sviluppati. Si se considerano assieme la sintomatologia peptica e quella reflussiva, si stima che oltre il 40% degli italiani soffrano di questi problemi almeno sporadicamente.
In realtà, occasionali episodi di semplice reflusso gastro-esofageo (RGE) sono da considerarsi fenomeni fisiologici. Si giunge tuttavia ad una condizioni patologica, la mRGE, quando il reflusso causa sintomi quali pirosi e rigurgito, e quando attraverso una esofagogastroduodenoscopia (EGDS) è possibile evidenziare condizioni infiammatorie, lesioni ulcerative o una trasformazione metaplasica della mucosa a carico dell’esofago.
Eziologia
La causa più comune di mRGE è costituita da unalterata funzionalità dello sfintere esofageo inferiore (LES), il quale, non funzionando correttamente, provoca una incongrua risalita di materiale gastro-biliare, con conseguente irritazione della mucosa esofagea. Una diminuzione del tono del LES si registra in seguito allassunzione di sostanze diverse, come cibi grassi, nicotina, caffeina, agrumi, alcolici ed anche alcuni tipi di farmaci.
Seconda causa in ordine di importanza può essere un rallentato svuotamento gastrico. Tanto più lungo è il periodo di permanenza gastrica del bolo alimentare, quanto maggiori sono le probabilità che si verifichino episodi reflussivi. Il valore soglia di svuotamento gastrico (T1/2) attualmente considerato per definire una gastroparesi è di 120 minuti. Pertanto, se il RGE si manifesta oltre questo tempo sarà da ricercarsi una concausa a valle del comparto gastro-esofageo; infatti, dopo 120 minuti, anche in caso di gastroparesi, il bolo alimentare transita anche solo per la forza di gravità.
Possono inoltre sussistere alterazioni della motilità esofagea, con conseguenti anomalie nella spinta propulsiva del bolo alimentare e nella clearance esofagea. Anche alterazioni salivari possono predisporre il soggetto a mRGE. Ricordiamo infatti che la saliva è leggermente basica ed essendo inoltre ricca di bicarbonati, è in grado di tamponare piccole quantità di acido accidentalmente risalite lungo lesofago. Se per qualche motivo il pH salivare si abbassa tale protezione viene meno e rende lesofago più suscettibile all`attacco acido.
La gravidanza, a causa della pressione esercitata dal feto, comprime lo stomaco facilitando la risalita di acido nell`esofago. Allo stesso modo negli obesi, la massiccia presenza di grasso addominale aumenta la pressione gastrica favorendo il reflusso. Anche il fumo è un fattore di rischio molto importante dato che altera la composizione salivare, la funzionalità dello sfintere gastroesofageo ed aumenta la secrezione acida dello stomaco.
Infine è importante ricordare l`ernia jatale che, soprattutto se di grosse dimensioni, molto spesso si associa alla malattia da reflusso gastroesofageo, definendo così una chiara condizione di interesse chirurgico.
Quadri clinici
Non sempre il quadro endoscopico e la sintomatologia clinica collimano. Possiamo distinguere i sintomi associati al RGE in esofagei ed extraesofagei.
I primi sono a loro volta divisi in tipici e atipici. Sintomi tipici sono la pirosi, ovvero quella sensazione di bruciore retrosternale, talora irradiata al collo o in sede interscapolare, ed il rigurgito provocato dalla risalita non forzata del contenuto gastrico fino al cavo orale. Tra i sintomi atipici, si ricordano la disfagia, cioè quella sensazione di difficoltà nella deglutizione, spesso legata ad alterazioni motorie correlate al reflusso, la deglutizione dolorosa o odinofagia ed il dolore toracico simil-anginoso, che spesso pone la necessità di una diagnosi differenziale con una sintomatologia coronarica.
Ma la mRGE può manifestarsi anche con sintomi extraesofagei, soprattutto delle vie aeree, quali tosse cronica, scialorrea, raucedine e disfonia, mentre raramente possono comparire asma cronico soprattutto notturno ed episodi di emoftoe.
Talvolta la sintomatologia associata a mRGE può entrare in diagnosi differenziale con il quadro clinico evocato da una colelitiasi complicata. Sebbene le due condizioni non mostrino franche correlazioni eziopatogenetiche, può essere utile approfondire la valutazione biliare attraverso un semplice esame ecografico.
L’interesse per la diagnosi e la cura della mRGE è data prevalentemente dalle richieste dei pazienti sulla base dei sintomi, ma anche dalla nota correlazione evolutiva, fortunatamente rara con una prevalenza inferiore all’1%, tra esofagite da mRGE, esofago di Barrett e Carcinoma esofageo.
Diagnosi
Una sintomatologia suggestiva per mRGE deve essere approfondita attraverso esami strumentali mirati. Una EGDS è fondamentale per la valutazione della mucosa esofagea, soprattutto nei pazienti con sintomi atipici o con ”segni di allarme” quali disfagia o mancata risposta alla terapia antisecretiva, nonchè per escludere altre patologie a carico del comparto esofago-gastro-duodenale.
Secondo la classificazione di Savary e Miller, si distinguono quattro gradi di lesioni endoscopiche:
- Grado 0: mucosa normale
- Grado 1: edema, iperemia, erosioni puntiformi non confluenti
- Grado 2: erosioni confluenti che non interessano l
intera circonferenza dellesofago - Grado 3: erosioni diffuse all
intera circonferenza dellesofago - Grado 4: ulcera, stenosi ed esofago di Barrett
Anche per la classificazione secondo il sistema di Los Angeles si riconoscono quattro diversi quadri endoscopici:
- Grado 1: una o più lesioni della mucosa di lunghezza non superiore ai 5-mm, nessuna delle quali si estende tra più apici delle pliche mucose.
- Grado 2: una o più lesioni della mucosa di lunghezza superiore ai 5-mm, nessuna delle quali si estende tra più apici delle pliche mucose.
- Grado 3: lesioni della mucosa che si estendendono tra due o più apici delle pliche mucose, ma non oltre il 75% della circonferenza esofagea.
- Grado 4: lesioni della mucosa che si estendendono per almeno il 75% della circonferenza esofagea
È utile inoltre ricercare la presenza dell`Helicobacter pylori a livello gastrico, per stabilire la condotta terapeutica più adeguata. Per quanto sia stata lungamente ricercata e studiata, un legame causale tra infezione da Helicobacter e mRGE non è mai stato accertato. La diagnosi di RGE patologico si perfeziona poi attraverso una pHmetria esofagea/ 24 ore, che consente di differenziare i reflussi fisiologici da quelli patologici. In taluni casi, anche reflussi ”fisiologici” possono provocare sintomi (”esofago irritabile o ipersensibile”). Per una diagnosi più coerente e certificabile soprattutto in casi di reflusso atipico, alcuni centri mettono a disposizione la pHmetria con impedenziometria multicanale intraluminale, che permette di valutare se il refluito giunge fino in gola, in che entità ed in quale forma (liquido, gassoso o biliare). Infine una manometria gastro-esofagea consente di definire il tono del LES.
Anatomia
Una corretta definizione della giunzione gastro-esofagea è da sempre difficoltosa, se non altro perchè il medesimo sito anatomico assume sfumature diverse per l’anatomista, l’endoscopista o il chirurgo. L’esofago, nella sua collocazione toracica tra pericardio anteriormente, aorta posteriormente e pleure a destra e sinistra (spazio di Portal) passa nel suo tratto più caudale attraverso lo jato esofageo, dando così il breve esofago addominale. Lo jato esofageo, sito proiettivamente a livello della vertebra D10, è costituito dalle componenti carnose dei pilastri diaframmatici, il destro di gran lunga più rappresentato del sinistro. A livello della giunzione esofago-cardiale si assiste alla transizione tra due epiteli, quello pavimentoso esofageo e quello gastrico, di morfologia cilindrica. L’angolatura descritta tra il margine sinistro dell’esofago addominale e la grande tuberosità gastrica forma l’angolo di His, acuto, la cui ampiezza diminuisce proporzionalmente al riempimento del fondo gastrico, costituendo così, attraverso il cosiddetto sperone valvolare di Von Gubaroff, il meccanismo fundico di controllo del reflusso. Il LES non corrisponde, come molti potrebbero pensare, al giunto esofago-gastrico, bensì viene identificato con un modesto ispessimento dello strato muscolare circolare esofageo (clasps di Liebermann) a circa 3-4 cm. dalla valvola cardiale, che tuttavia costituisce una struttura anatomo-funzionale capace di contrazioni fino a gradienti pressori di 12-30 mmHg. I mezzi fisici di fissazione del giunto esofago-gastrico sono diversi: dalla membrana freno-esofagea di Laimer-Bertelli al legamento gastro-frenico, dalla pars condensa del piccolo omento all’ancre de Moynihan, fino al grasso dello spazio retroesofageo di Nyhus.
Trattamento chirurgico
Indubbiamente l’introduzione e la diffusione prima dei farmaci antiacidi ed antiH2 (cimetidina e ranitidina), poi, nei primi anni ’90 degli inibitori di pompa protonica (PPI), ha rivoluzionato il trattamento della mRGE, invertendo il trend di cura a favore della terapia farmacologica.
Oggi, le indicazioni alla trattamento chirurgico sono ben precise e riguardano situazioni caratterizzate da sintomi persistenti e ricorrenti, da insorgenza di complicanze dopo terapia con PPI, da pazienti giovani o che mostrino cattiva compliance alla terapia medica. In tutti questi casi deve essere documentato un reflusso patologico alla pHmetria/ 24 h, a cui si sommano condizioni di LES ipotonico o corto alla manometria.
Attualmente la tecnica laparoscopica rappresenta il gold standard di trattamento per una mRGE con indicazione chirurgica, mentre il tradizionale accesso open è stato sostanzialmente abbandonato o quantomeno relegato a casi altamente selezionati ed con controindicazioni assolute verso la laparoscopia.
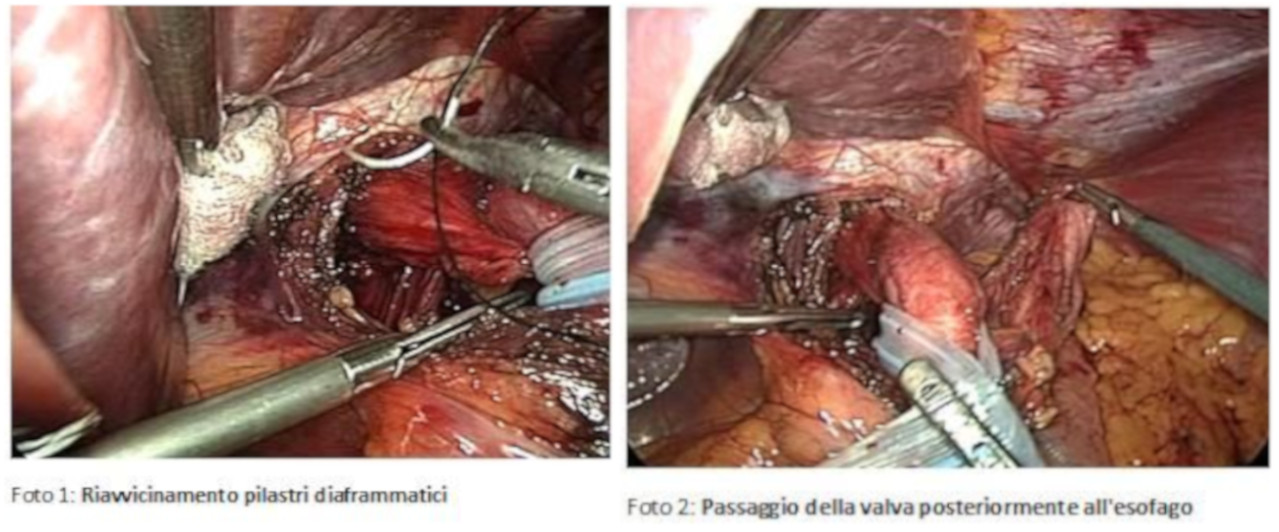
Dal punto di vista tecnico, la plastica antireflusso laparoscopica non differisce nella sostanza dall’approccio tradizionale, rispettando i tempi fondamentali dell’intervento. Questi sono la dissezione e mobilizzazione dell’esofago per ricostituirne il segmento endoaddominale, con eventuale riduzione in addome dell’ernia jatale se presente, il riavvicinamento dei pilastri posteriormente all’esofago o jatoplastica (Foto 1), ed infine il confezionamento di una valva retroesofagea senza tensione (Foto 2). Tutto ciò viene però eseguito attraverso 4 o 5 incisioni centimetriche a livello dell’emiaddome superiore.
La sezione o meno dei vasi gastrici brevi, sempre meno utilizzata benché tecnicamente utile in taluni casi, non determina differenze significative in termini di tasso di reintervento, complicanze e degenza post-operatorie, né per quanto riguarda disfagia o reflusso post-operatori [vi].
La plastica antireflusso si prefigge lo scopo di aumentare la pressione e la lunghezza addominale del LES, attraverso un’occlusione pneumatica del cardias con conseguente incremento della pressione endogastrica. Tale procedura migliora inoltre la contrattilità del corpo esofageo e lo svuotamento gastrico.
Numerose e di elevata evidenza sono le esperienze di letteratura che hanno comparato la fundoplicatio eseguita con approccio open e laparoscopico [vii] [viii], tali da far dire allo stesso Dallemagne nel 2011 che la questione se eseguire questo tipo di intervento con tecnica tradizionale o mininvasiva non ha più motivo di essere posta[ix], sottintendendo l’attuale indicazione esclusiva ad un trattamento laparoscopico.
A oltre 20 anni di distanza dal primo intervento di questo tipo, possiamo oggi affermare che la fundoplicatio laparoscopica consolida il suo ruolo di intervento di scelta per il trattamento chirurgico della mRGE, garantendo risultati funzionali a breve e lungo termine quantomeno sovrapponibili alla tecnica open, in abbinamento ad un minor dolore post-operatorio, migliori risultati estetici, una degenza più breve ed un più rapido ritorno alla vita attiva da parte del paziente.
Il tasso di reintervento è stimato nelle varie casistiche tra il 4 ed il 13%, mentre la percentuale di pazienti che tornano alla terapia farmacologia con PPI entro 10 anni dall’intervento è del 10-22%, sebbene molti Studi abbiano dimostrato che la maggioranza di questi pazienti non abbia una mRGE recidiva oggettivamente documentabile [x] [xi]. La plastica antireflusso laparoscopica è quindi una tacnica fattibile, ben riproducibile e diffusibile. Per ottenere una proficiency tecnica e funzionale, la learning curve specifica viene stimata attorno alle 20 – 30 procedure per chirurgo, mentre un adeguato case-volume si traduce in circa 50 procedure per Istituzione [xii] [xiii].
Una corretta indicazione, uno studio funzionale accurato ed una tecnica chirurgica standardizzata sono il presupposto fondamentale per il conseguimento di buoni risultati immediati e a distanza.
reflusso gastroesofageo 01Il trattamento chirurgico della mRGE nasce nel 1956 (figura sotto), quando Rudolph Nissen propone per la prima volta la tecnica antireflusso che prenderà il suo nome[i], e che rappresenta ad oggi una pietra angolare della chirurgia antireflussiva. Si tratta di una plastica a 360°, ovvero con una completa rotazione e plicatura del fondo gastrico sull’esofago distale, così da rinforzare il meccanismo sfinteriale del LES.

Da questa geniale intuizione chirurgica hanno poi preso le mosse alcune varianti tecniche, dalle plastiche parziali, a 180 o 270°, con valva anteriore o posteriore (Dor, Toupet, Belsey) [ii] [iii], alle cosiddette “floppy” Nissen [iv] [v], concepite e realizzate in modo da minimizzare eventuali esiti stenotici. Nel 1991 poi, in piena “endoscopic explosion” per usare le parole di Sir Alfred Cuschieri, Dallemagne esegue per primo una fundoplicatio con tecnica laparoscopica.
Bibliografia
- Nissen R. Eine einfache Operation zur Beeinflussung der Refluxoesophagitis. Schweiz Med Wochenschr 1956; 86: 590-2.
- Toupet A.Technique d’aesophagogastroplastie appliquée à la cure radicale des hernies hiatales et comme complément de l’opération de Heller dans les cardiospasmes. Med Acad Chir (Paris) 1963; 89: 384-9.
- Rossetti M, Hell K. Fundoplication for the treatment of gastroesophageal reflux in hiatal hernia. World J Surg 1977; 1: 439-444.
- Donahue PE, Samuelson S, Nyhus LM et Al. The floppy Nissen fundoplication: effective long-term control of pathogenic reflux. Arch Surg 1985; 120: 663-7.
- DeMeester TR, Bonavina L, Albertucci M. Nissen fundoplication for gastroesophageal reflux. Evaluation of primary repair in 100 consecutive patients. Ann Surg 1986; 204: 9-20.
- Markar SR, Karthikesalingam AP, Wagner OJ, Jackson D, Hewes JC, Vyas S, Hashemi M. Systematic review and meta-analysis of laparoscopic Nissen fundoplication with or without division of the short gastric vessels. Br J Surg 2011;98: 1056-62.
- Bais JE, Bartelsman JF, Bonjer HJ, Cuesta MA, Go PM, Klinkenberg-Knol EC, van Lanschot JJ, Nadorp JH, Smout AJ, van der Graaf Y, Gooszen HG. Laparoscopic or conventional Nissen fundoplication for gastro-oesophageal reflux disease: randomised clinical trial. The Netherlands Antireflux Surgery Study Group. Lancet 2000; 355: 170-4.
- Chrysos E, Tsiaoussis J, Athanasakis E, Zoras O, Vassilakis JS, Xynos E. Laparoscopic vs open approach for Nissen fundoplication. A comparative study. Surg Endosc 2002; 16: 1679-84.
- Dallemagne B, Perretta S. Twenty years of laparoscopic fundoplication for GERD. World J Surg 2011; 35: 1428-35.
- Fein M, Bueter M, Thalheimer A, Pachmayr V, Heimbucher J, Freys SM, Fuchs KH. Ten-year outcome of laparoscopic antireflux surgery. J Gastrointest Surg 2008; 12: 1893-9.
- Broeders JA, Rijnhart-de Jong HG, Draaisma WA, Bredenoord AJ, Smout AJ, Gooszen HG. Ten-year outcome of laparoscopic and conventional nissen fundoplication: randomized clinical trial. Ann Surg 2009; 250: 698-706.
- Watson DI, Baigrie RJ, Jamieson GG. A learning curve for laparoscopic fundoplication. Definable, avoidable, or a waste of time? Ann Surg 1996; 224: 198-203. 13. Hwang H, Turner LJ, Blair NP. Examining the learning curve of laparoscopic fundoplications at an urban community hospital. Am J Surg 2005; 189: 522-6.